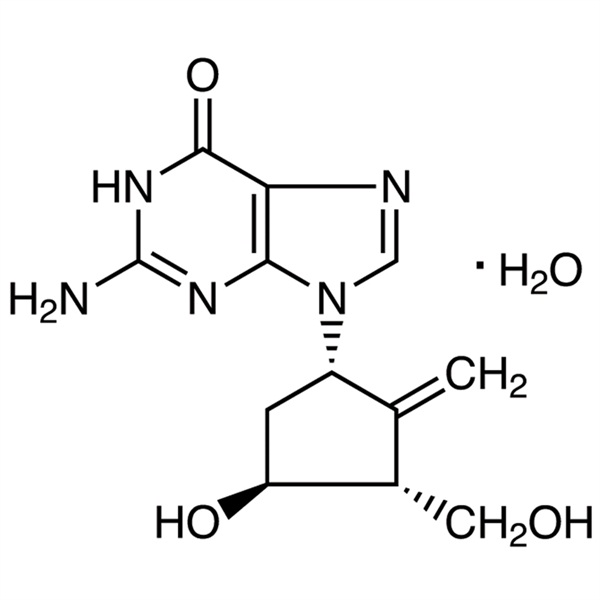
Ensaio 98,0%~102,0% CAS 209216-23-9 do monohidrato de entecavir infecção antiviral padrão da hepatite B do API USP EP
A Ruifu Chemical é fornecedora líder de monohidrato de entecavir (CAS: 209216-23-9) de alta qualidade, podendo atender ao padrão USP/EP, utilizado no tratamento da infecção por hepatite B.
A Ruifu fornece APIs e intermediários farmacêuticos há mais de 15 anos.
A Ruifu Chemical pode fornecer entrega em todo o mundo, preço competitivo e serviço excelente.
Compre Entecavir Monohidrato, entre em contato conosco pelo e-mail: alvin@ruifuchem.com
| Nome Químico | Entecavir Monohidrato |
| Sinônimos | Hidrato de Entecavir; 9-[(1S,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina Monohidrato |
| Número CAS | 209216-23-9 |
| Status do estoque | Em estoque, produção em até toneladas |
| Fórmula Molecular | C12H17N5O4 |
| Peso molecular | 295,3 |
| Ponto de fusão | >220°C |
| Densidade | 1,81 |
| Condição de envio | Enviado sob temperatura ambiente |
| COA e MSDS | Disponível |
| Origem do Produto | Xangai, China |
| Categorias de produtos | API (Ingrediente Farmacêutico Ativo) |
| Marca | Ruifu Química |
| Artigo | Especificações |
| Aparência | Pó cristalino branco ou quase branco |
| Solubilidade | Livremente solúvel em dimetilformamida, ligeiramente solúvel em água, etanol e metanol |
| RI de identificação | O espectro da amostra corresponde ao do padrão de referência |
| HPLC de identificação | O tempo de retenção da amostra de teste corresponde ao do padrão de referência |
| Conteúdo de água (por K.F) | 5,5%~6,5% |
| Rotação óptica específica | +24,0° a +30,0° (DMF: MeOH=1:1 C=1%) (em substância anidra) |
| Resíduo na ignição | ≤0,10% |
| Substâncias Relacionadas | |
| Furoentecavir | ≤0,10% |
| Entecavir 1-Epímero | ≤0,10% |
| Entecavir 3-Epímero | ≤0,10% |
| 8-Hidroxi-Entecavir | ≤0,10% |
| Entecavir 4-Epímero | ≤0,10% |
| 8-Metoxi Entecavir | ≤0,10% |
| 4-Dimetilsilil Entecavir | ≤0,10% |
| Composto A relacionado ao entecavir | ≤0,10% |
| Qualquer Impureza Não Especificada | ≤0,10% |
| Impurezas Totais | ≤0,30% |
| Solventes Residuais | |
| Metanol | ≤600 ppm |
| Diclorometano | ≤300 ppm |
| Acetato de Etila | ≤1000 ppm |
| Tetrahidrofurano | ≤720 ppm |
| Tolueno | ≤890 ppm |
| Cloreto de Benzila | ≤1000 ppm |
| Álcool Benzílico | ≤1000 ppm |
| Limite Microbiano | |
| Contagens aeróbicas totais | ≤100ufc/g |
| Leveduras e Bolores | ≤10ufc/g |
| Escherichia Coli | Não deve ser detectado |
| Metais Pesados | ≤10 ppm |
| Ensaio | 98,0%~102,0% (HPLC; na base anidra) |
| Tamanho de partícula | 95% das partículas devem estar dentro de 125μm |
| Padrão de teste | Padrão Empresarial; Padrão da Farmacopeia dos Estados Unidos (USP) |
| Uso | Medicamento antiviral usado no tratamento da infecção por hepatite B |
Pacote: Garrafa, saco de papel alumínio, tambor de 25kg/papelão, ou conforme necessidade do cliente.
Condição de armazenamento: Mantenha o recipiente bem fechado. Armazenar em local fresco, seco (2-15℃) e bem ventilado, longe de substâncias incompatíveis. Mantenha longe da luz solar; evite fontes de fogo e calor; evite a umidade.
Envio: Entregue para todo o mundo por via aérea, marítima, por FedEx / DHL Express. Fornece entrega rápida e confiável.

| Descrição de segurança | 24/25 - Evite o contato com a pele e os olhos. |
| Código HS | 2933990099 |
Entecavir Monohidratado (CAS 209216-23-9) é um medicamento antiviral oral usado no tratamento da infecção pelo vírus da hepatite B (HBV). Entecavir Monohidrato é um análogo de nucleosídeo (mais especificamente, um análogo de guanina) que inibe a transcrição reversa, a replicação do DNA e a transcrição no vira. É um novo tipo de medicamento ciclopentil acil guanosina anti-vírus da hepatite B com efeitos farmacológicos semelhantes aos do Entecavir. É clinicamente aplicado ao tratamento da hepatite B crônica em adultos, na qual há replicação viral ativa, aumento da transaminase sérica ALT ou lesões ativas mostradas na histologia do fígado. O Entecavir Monohidratado é um inibidor potente e seletivo do VHB, com CE50 de 3,75 nM em células HepG2. Entecavir é um inibidor da transcriptase reversa. Impede a multiplicação do vírus da hepatite B (HBV) e reduz a quantidade de vírus no corpo.
Entecavir
C12H15N5O3·H2O 295,29
6H-Purina-6-ona, 2-amino-1,9-dihidro-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenociclopentil]-, monohidrato;
9-[(1S,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina monohidratada [209216-23-9]; UNII: 5968Y6H45M.
Anidro 277,28
DEFINIÇÃO
O Entecavir é um monohidrato e contém 98% de NLT e 102% de NMT de Entecavir (C12H15N5O3), calculado na base anidra.
IDENTIFICAÇÃO
Mude para ler:
• A. TESTES DE IDENTIFICAÇÃO ESPECTROSCÓPICA<197>, Espectroscopia de Infravermelho: 197A ou 197K (CN 1-Maio-2020)
• B. O tempo de retenção do pico maior da solução Amostra corresponde ao da solução Padrão, conforme obtido no Ensaio.
ENSAIO
• PROCEDIMENTO
Solução A: Acetonitrila e água (3:97)
Solução B: Acetonitrila
Fase móvel: Ver Tabela 1. [NOTA- Os tempos de eluição gradiente são estabelecidos em um sistema HPLC com volume de permanência de aproximadamente 1,0 mL.]
Tabela 1 Tempo (min) Solução A (%) Solução B (%)
0 100 0
8 100 0
50 77 23
75 17 83
90 100 0
100 100 0
Solução estoque de adequação do sistema: 1,0 mg/mL de USP Entecavir System Suitability Mixture RS em metanol
Solução de adequação do sistema: 0,2 mg/mL de Entecavir System Suitability Mixture RS da USP na Solução A da solução estoque de adequação do sistema
Solução estoque padrão: 1,0 mg/mL de USP Entecavir Monohidrato RS em metanol. Sonice conforme necessário.
Solução padrão: 0,2 mg/mL de Entecavir Monohidrato RS da USP na Solução A da solução estoque padrão
Solução estoque amostra: 1,0 mg/mL de Entecavir em metanol. Sonice conforme necessário.
Solução amostra: 0,2 mg/mL de Entecavir na Solução A da solução estoque amostra
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: UV 254nm
Coluna: 4,6-mm × 25-cm; Embalagem L1 de 5-µm
Taxa de fluxo: 1 mL/min
Volume de injeção: 10 μL
Adequação do sistema
Amostras: solução de adequação do sistema e solução padrão
[NOTA- Consulte a Tabela 2 para obter os tempos de retenção relativos dos componentes na solução de adequação do sistema.]
Requisitos de adequação
Resolução: NLT 3,5 entre entecavir 1-epímero e entecavir; NLT 2.0 entre entecavir e 8-hidroxi entecavir, Sistema
solução de adequação
Fator de cauda: 0,8-1,5 para entecavir, solução de adequação do sistema
Desvio padrão relativo: NMT 1,5%, solução padrão
Análise
Amostras: solução padrão e solução amostral
Calcule a percentagem de entecavir (C12H15N5O3) na porção de Entecavir tomada:
Resultado = (ru /rs) × (Cs /Cu) × 100
ru = pico de resposta do entecavir da solução amostra
rs = pico de resposta do entecavir da solução padrão
Cs = concentração de Entecavir Monohidrato RS USP na solução padrão (mg/mL)
Cu = concentração de Entecavir na solução amostra (mg/mL)
Critérios de aceitação: 98%-102% na base anidra
IMPUREZAS
• IMPUREZAS ORGÂNICAS
Solução A, Solução B, Fase móvel, Solução stock de adequação do sistema, Solução stock de adequação do sistema, Solução stock de amostra, Solução de amostra e Sistema cromatográfico: Proceda conforme indicado no Ensaio.
Solução estoque padrão: Use a solução padrão do ensaio.
Solução padrão: 0,2 µg/mL de Entecavir Monohidrato RS da USP na Solução A da solução estoque padrão
Adequação do sistema
Amostras: solução de adequação do sistema e solução padrão
[NOTA- Consulte a Tabela 2 para obter os tempos de retenção relativos dos componentes na solução de adequação do sistema.]
Requisitos de adequação
Resolução: NLT 3,5 entre entecavir 1-epímero e entecavir; NLT 2.0 entre entecavir e 8-hidroxi entecavir, solução de adequação do sistema
Fator de cauda: 0,8-1,5 para entecavir, solução de adequação do sistema
Desvio padrão relativo: NMT 10,0%, solução padrão
Análise
Amostras: Solução amostral e solução padrão
Calcule a porcentagem de cada impureza na porção de Entecavir tomada:
Resultado = (ru /rs) × (Cs /Cu) × (1/F) × 100
ru = resposta de pico de cada impureza da solução amostral
rs = pico de resposta do entecavir da solução padrão
Cs = concentração de Entecavir Monohidrato RS USP na solução padrão (mg/mL)
Cu = concentração de Entecavir na solução amostra (mg/mL)
F = fator de resposta relativo (ver Tabela 2)
Critérios de aceitação: Ver Tabela 2. Desconsiderar qualquer pico inferior a 0,05%.
Tabela 2
Nome Critérios de aceitação do fator de resposta relativo do tempo de retenção relativo, NMT (%)
Furoentecavir a 0,73 1,0 0,1
Entecavir 1-epímero b 0,93 1,0 0,1
Entecavir 3-epímero c 0,96 1,0 0,1
Entecavir 1.0 - -
8-Hidroxi entecavir d 1,03 0,67 0,1
Entecavir 4-epímero e 1,08 1,0 0,1
8-Metoxi entecavir f 1,27 0,67 0,1
4-Dimetilsilil entecavir g 1,84 1,0 0,1
Composto A 3.41 relacionado ao entecavir - -
Qualquer impureza não especificada - 1,0 0,1
Impurezas totais i - - 0,3
a 9-[(3aS,4S,6S,6aR)-3a,6-Dihidroxihexahidro-1H-ciclopenta[c]furano-4-il]guanina.
b 9-[(1R,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina.
c 9-[(1S,3S,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina.
d 8-Hidroxi-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina.
e 9-[(1S,3R,4R)-4-Hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina.
f 8-Metoxi-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenociclopentil]guanina.
g 9-[(1S,3R,4S)-4-Hidroxidimetilsilil-3-(hidroximetil)-2-metilenociclopentil]guanina.
h Apenas para informação; quantificado no teste para Limite do Composto A Relacionado ao Entecavir.
i Inclui a soma de todas as impurezas encontradas nos testes de Limite do Composto A Relacionado ao Entecavir e Impurezas Orgânicas.
• LIMITE DO COMPOSTO A RELACIONADO A ENTECAVIR
Solução A: 0,1% (v/v) de ácido trifluoroacético em água
Solução B: 0,1% (v/v) de ácido trifluoroacético em acetonitrila
Fase móvel: Ver Tabela 3. [ NOTA- Os tempos de eluição gradiente são estabelecidos em um sistema HPLC com um volume de permanência de
aproximadamente 1,0 mL.]
Tabela 3
Tempo (min) Solução A (%) Solução B (%)
0 65 35
8 53 47
8,1 65 35
11 65 35
Solução padrão: 2 µg/mL de Composto A RS relacionado ao Entecavir da USP em metanol
Solução amostra: 1,0 mg/mL de Entecavir em metanol. Sonice conforme necessário.
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: UV 254nm
Coluna: 4,6-mm × 5-cm; Embalagem L1 de 5-µm
Temperaturas
Amostrador automático: 4°
Coluna: 30°
Taxa de fluxo: 2 mL/min
Volume de injeção: 10 μL
Adequação do sistema
Amostra: Solução padrão
Requisitos de adequação
Fator de cauda: 0,8-1,5
Desvio padrão relativo: NMT 3,0%
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem do composto A relacionado ao entecavir na porção de Entecavir tomada:
Resultado = (ru /rs) × (Cs /Cu) × 100
ru = resposta máxima do composto A relacionado ao entecavir da solução amostra
rs = resposta máxima do composto A relacionado ao entecavir da solução padrão
Cs = concentração de Composto A RS relacionado ao Entecavir da USP na solução padrão (mg/mL)
Cu = concentração de Entecavir na solução amostra (mg/mL)
Critérios de aceitação: NMT 0,1%
TESTES ESPECÍFICOS
• DETERMINAÇÃO DE ÁGUA<921>, Método I, Método Ic: 5,5%-7,0%
• ROTAÇÃO ÓPTICA<781S>, Procedimentos, Rotação Específica
Solução amostra: 10 mg/mL de Entecavir em mistura de dimetilformamida e metanol (50:50)
Critérios de aceitação: +24° a +30°
REQUISITOS ADICIONAIS
• EMBALAGEM E ARMAZENAGEM: Conservar em recipientes bem fechados e protegidos da luz. Armazene em temperatura ambiente.
• PADRÕES DE REFERÊNCIA USP<11>
USP Entecavir Monohidrato RS
Composto A RS relacionado ao Entecavir da USP
3-Benzil-4-silil entecavir;
9-[(1S,3R,4S)-4-Dimetilfenilsilil-3-(benziloximetil)-2-metilenociclopentil]guanina.
C27H31N5O2Si 485,65
Mistura RS de adequação do sistema Entecavir da USP
A mistura contém entecavir monohidratado e as seguintes impurezas (outras impurezas também podem estar presentes):
Entecavir 1-epímero.
8-Hidroxi entecavir.
8-Metoxi entecavir.