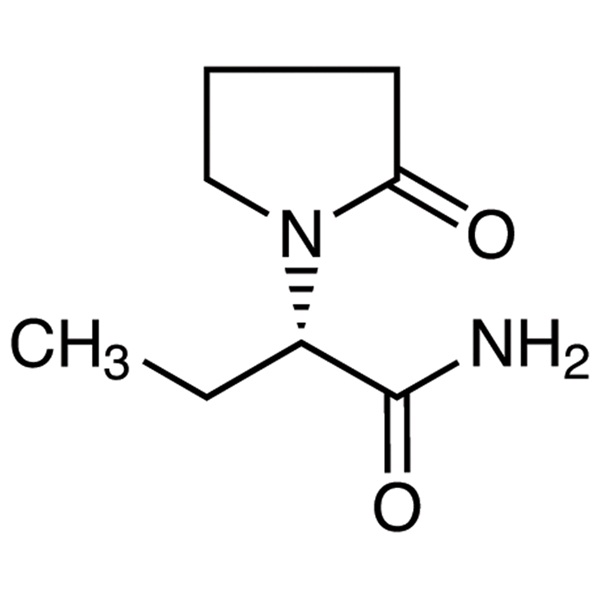
Levetiracetam LEV CAS 102767-28-2 Ensaio 98,0%~102,0% Padrão USP EP
Shanghai Ruifu Chemical Co., Ltd. é o fabricante líder de Levetiracetam (CAS: 102767 - 28 - 2) com alta qualidade e qualidade estável, API, padrão USP/EP, medicamento antiepiléptico de terceira geração. A Ruifu Chemical pode fornecer entrega em todo o mundo, preço competitivo, serviço excelente, quantidades pequenas e a granel disponíveis. Compre Levetiracetam, Entre em contato: alvin@ruifuchem.com
| Nome Químico | Levetiracetam |
| Sinônimos | LEV; (S)-2-(2-Oxo-1-pirrolidinil)butiramida; UCB-L059; (S)-alfa-Etil-2-Oxo-1-Pirrolidinaacetamida; (2S)-2-(2-Oxopirrolidina-1-il)butanamida |
| Número CAS | 102767-28-2 |
| Status do estoque | Em estoque, capacidade de produção de 500 toneladas por ano |
| Fórmula Molecular | C8H14N2O2 |
| Peso molecular | 170,21 |
| Ponto de fusão | 116,0 ~ 119,0 ℃ |
| Densidade | 1,168g/cm3 |
| Solubilidade | Solúvel em Acetona |
| COA e MSDS | Disponível |
| Origem do Produto | Xangai, China |
| Categorias de produtos | Antiepiléptico; API (Ingrediente Farmacêutico Ativo) |
| Marca | Ruifu Química |
| Artigo | Especificações |
| Aparência | Pó de cristais brancos ou quase brancos |
| Identificação | IR |
| Aparência da solução | Transparente e não mais intensamente colorido que BY6 |
| Limite de Levetiracetam R-Enantiômero | ≤0,80% |
| Água (por KF) | ≤0,50% |
| Resíduo na ignição | ≤0,10% |
| Metais Pesados | ≤0,001% |
| Substâncias Relacionadas | |
| Piridina-2-ol | ≤0,025% |
| Ácido Levetiracetam | ≤0,30% |
| Composto A relacionado ao levetiracetam | ≤0,05% |
| Composto B relacionado ao levetiracetam | ≤0,10% |
| Qualquer Impureza Individual Não Especificada | ≤0,05% |
| Total de Impurezas Não Especificadas | ≤0,10% |
| Impurezas Totais | ≤0,40% |
| Solventes Residuais | Conheça a especificação |
| Ensaio/Método de Análise | 98,0% ~ 102,0% (calculado na base anidra e solvente - livre) |
| Padrão de teste | Padrão USP; Padrão EP |
| Aplicação | API; Medicamento Antiepiléptico de Terceira-Geração |
Pacote: Garrafa, saco de papel alumínio, 25kg/tambor de papelão, ou conforme necessidade do cliente.
Condição de armazenamento: Mantenha o recipiente bem fechado e armazene em local fresco, seco e bem - ventilado, longe de substâncias incompatíveis. Mantenha longe da luz solar; evite fontes de fogo e calor; evite a umidade.
Envio: Entregue para todo o mundo por via aérea, por FedEx / DHL Express. Fornece entrega rápida e confiável.
Levetiracetam
C8H14N2O2 170,21
1-Pirrolidinaacetamida, -etil-2-oxo-, (S)-;
()-(S)--Etil-2-oxo-1-pirrolidinaacetamida [102767-28-2].
DEFINIÇÃO
Levetiracetam contém NLT 98,0% e NMT 102,0% de C8H14N2O2, calculado na base anidra e livre de solvente.
IDENTIFICAÇÃO
• A. Absorção infravermelha<197K>
• B. O tempo de retenção do pico principal do levetiracetam da solução de amostra corresponde ao do enantiômero S-de levetiracetam da solução de adequação do sistema, conforme obtido no teste de Limite do Enantiômero R-de Levetiracetam.
ENSAIO
• Procedimento
Tampão: 2,7 g/L de fosfato de potássio monobásico em água. Ajustar com hidróxido de potássio aquoso a 2% (p/v) para um pH de 5,5.
Solução A: Acetonitrila e Tampão (1:19)
Solução B: Acetonitrila
Fase móvel: Veja a tabela de gradiente abaixo.
Tempo (min) Solução A (%) Solução B (%)
0 100 0
3 100 0
20 71 29
Solução de adequação do sistema: 0,2 mg/mL de USP Levetiracetam RS e 0,08 mg/mL de USP Levetiracetam Composto A RS na Solução A. Prepare dissolvendo primeiro a quantidade necessária de USP Levetiracetam RS em um balão volumétrico adequado. Adicione 10% do volume do frasco de hidróxido de potássio 0,1 N. Deixe a mistura reagir à temperatura ambiente durante cerca de 15 min e depois neutralize adicionando ácido clorídrico 0,1 N a 10% do volume do frasco. Adicione a quantidade necessária de Composto A RS relacionado ao levetiracetam USP, sonicar para dissolver, diluir com a Solução A até o volume e misturar.
Solução padrão: 0,1 mg/mL de Levetiracetam RS USP na Solução A
Solução amostra: 0,1 mg/mL de Levetiracetam na Solução A
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: UV 205 nm
Coluna: 4,6-mm × 15-cm; embalagem L1
Taxa de fluxo: 0,9 mL/min
Tamanho da injeção: 10 μL
Adequação do sistema
Amostra: Solução de adequação do sistema
[Nota-Os tempos de retenção relativos são fornecidos na Tabela de Impureza 1.]
Requisitos de adequação
Desvio padrão relativo: NMT 1,0%
[Nota-Se os critérios de adequação do sistema não puderem ser atendidos, recomenda-se que a temperatura da coluna seja mantida em 20ºC para estabilizar o sistema.]
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de C8H14N2O2 na porção de Levetiracetam tomada:
Resultado = [(rU/rS) × (CS/CU) × 100] F
rU = resposta máxima do levetiracetam da solução amostra
rS = resposta máxima do levetiracetam da solução padrão
CS = concentração de Levetiracetam RS USP na solução padrão (mg/mL)
CU = concentração de Levetiracetam na solução amostra (mg/mL)
F = porcentagem de enantiômero R-de levetiracetam do teste para Limite de enantiômero R-de Levetiracetam
Critérios de aceitação: 98,0%-102,0% na base anidra e livre de solventes
IMPUREZAS
Impurezas Inorgânicas
• Resíduo na ignição<281>: NMT 0,1%
• Metais Pesados, Método II<231>: 20 ppm
Impurezas Orgânicas
• Procedimento 1: Limite do Composto B Relacionado ao Levetiracetam
[Nota-Realize este teste apenas se o composto B relacionado ao levetiracetam for uma impureza de processo conhecida.]
Tampão: 1,22 g de 1-decanosulfonato de sódio em 1 L de água contendo cerca de 1,3 mL de ácido fosfórico. Ajuste com hidróxido de potássio a 20% (p/v) para um pH de 3,0.
Fase móvel: Acetonitrila e Tampão (3:17)
Solução de adequação do sistema: 2 mg/mL de Composto B RS relacionado ao levetiracetam da USP na fase móvel
Solução padrão: 0,002 mg/mL de Composto B RS relacionado ao levetiracetam da USP na fase móvel
Solução amostra: 2,0 mg/mL de Levetiracetam em Fase Móvel
Sistema cromatográfico
(Ver Cromatografia 621, Adequação do Sistema.)
Modo: LC
Detector: UV 200nm
Coluna: 4,6-mm × 25-cm; embalagem L1
Taxa de fluxo: 1,0 mL/min
Tamanho da injeção
Adequação do sistema: 10 μL
Análise: 50 µL
Adequação do sistema
Amostra: Solução de adequação do sistema
[Nota-O tempo de retenção do composto B relacionado ao levetiracetam é de 9 min.]
Requisitos de adequação
Fator de cauda: NMT 3.0
[Nota-Se for observada uma cauda significativa do pico do composto B relacionado ao levetiracetam (maior que 3,0), recomenda-se que a temperatura da coluna seja mantida em 27ºC para estabilizar o sistema.]
Desvio padrão relativo: NMT 2,0%
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem do composto B relacionado ao levetiracetam na porção de Levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = resposta de pico do composto B relacionado ao levetiracetam da solução amostra
rS = resposta de pico do composto B relacionado ao levetiracetam da solução padrão
CS = concentração de Composto B RS relacionado ao levetiracetam USP na solução padrão (mg/mL)
CU = concentração de Levetiracetam na solução amostra (mg/mL)
Mr1 = peso molecular da base livre do composto B relacionado ao levetiracetam, 102,1
Mr2 = peso molecular do composto B relacionado ao levetiracetam, 138,6
Critérios de aceitação: NMT 0,10%
[Nota-A quantidade de composto B relacionado ao levetiracetam medida deve ser incluída no total de impurezas no teste para Impurezas Orgânicas, Procedimento 2.]
• Procedimento 2
Tampão, Solução A, Solução B, Fase Móvel, Solução de Adequação do Sistema e Sistema Cromatográfico: Proceda conforme indicado no Ensaio.
Solução padrão: 0,005 mg/mL de Levetiracetam RS USP na Solução A
Solução amostra: 5 mg/mL de Levetiracetam na Solução A
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de cada impureza na porção de Levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = resposta de pico de cada impureza da solução amostral
rS = resposta máxima do levetiracetam da solução padrão
CS = concentração de Levetiracetam RS USP na solução padrão (mg/mL)
CU = concentração de Levetiracetam na solução amostra (mg/mL)
F = fator de resposta relativo (ver Tabela de Impureza 1)
[Nota-Desconsidere qualquer pico com um tempo de retenção relativo de 0,19 ou menos.]
Critérios de aceitação
Impurezas individuais: Consulte a Tabela de Impurezas 1.
Impurezas totais: NMT 0,4%
Tabela de Impureza 1
Nome Critérios de aceitação do fator de resposta relativo do tempo de retenção relativo, NMT (%)
Piridina-2-ol a 0,37 1,0 0,025
Levetiracetam ácidob 0,62 1,2 0,3
Levetiracetam 1,00 - -
Composto relacionado ao levetiracetam Ac 1,25 0,35 0,05
Qualquer impureza individual não especificada - 1,0 0,05
a Não incluído no limite Total de impurezas.
ácido b (S)-2-(2-Oxopirrolidina-1-il)butanóico. Incluído no limite Total de impurezas.
c (S)-N-(1-Amino-1-oxobutan-2-il)-4-clorobutanamida. Incluído no limite de impurezas totais apenas se o composto B relacionado ao levetiracetam for uma impureza de processo conhecida.
TESTES ESPECÍFICOS
• Determinação de Água, Método Ia<921>: NMT 0,5%
• Limite de Levetiracetam R-Enantiômero
Fase móvel: n-Hexano e álcool desidratado (4:1)
Solução de adequação do sistema: 0,1 mg/mL de USP Levetiracetam Racemic Mixture RS em fase móvel
Solução padrão: 0,05 mg/mL de Levetiracetam RS USP em fase móvel
Solução amostra: 10 mg/mL de Levetiracetam em Fase Móvel
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: UV 215nm
Coluna: 4,6-mm × 25-cm; Embalagem de 10-µm L51
Taxa de fluxo: 1,0 mL/min
Tamanho da injeção: 20 μL
Adequação do sistema
Amostra: Solução de adequação do sistema
[Nota-Os tempos de retenção relativos para o enantiômero R-de levetiracetam e o enantiômero S-de levetiracetam são 0,55 e 1,0, respectivamente.]
Requisitos de adequação
Resolução: NLT 4.0 entre o R- e S-enantiômeros
[Nota-Se for observada uma perda de resolução (menos de 4,0), recomenda-se que a temperatura da coluna seja mantida em 25ºC para estabilizar o sistema.]
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de enantiômero R - de levetiracetam na porção de Levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = resposta de pico do enantiômero R-de levetiracetam da solução amostra
rS = resposta máxima do levetiracetam da solução padrão
CS = concentração de Levetiracetam RS USP na solução padrão (mg/mL)
CU = concentração de Levetiracetam na solução amostra (mg/mL)
Critérios de aceitação: NMT 0,8%
REQUISITOS ADICIONAIS
• Embalagem e Armazenamento: Conservar em recipientes bem fechados e armazenar em temperatura ambiente.
• Padrões de referência da USP<11>
USP Levetiracetam RS
Mistura racêmica de levetiracetam USP RS
Uma mistura 1:1 de levetiracetam S-enatiomer-(2S)-2-(2-oxopirrolidin-1-yl)butanamida e levetiracetam R-enantiômero (2R)-2-(2-oxopirrolidin-1-yl)butanamida.
Composto A RS relacionado ao levetiracetam da USP
(S)-N-(1-Amino-1-oxobutan-2-il)-4-clorobutanamida.
C8H14ClNO3 207,65
Composto B RS relacionado ao levetiracetam da USP
(S)-2-Cloridrato de aminobutanamida.
C4H10N2O·HCl 138,6

O levetiracetam (CAS: 102767-28-2), um derivado do picetam, é um novo medicamento antiepiléptico de terceira geração aprovado pelo FDA dos EUA em 1999. Foi inicialmente usado para o tratamento adjuvante de crises parciais em adultos. Em 2005, o Levetiracetam foi aprovado em comprimidos orais e soluções para o tratamento adjuvante de crises parciais em crianças com 4 anos ou mais. É utilizado principalmente no tratamento aditivo de crises parciais em adultos e crianças maiores de 4 anos, podendo também ser utilizado apenas para crises parciais e crises sistêmicas em adultos. Também tem certo efeito curativo na epilepsia mioclônica em adolescentes, epilepsia refratária, epilepsia ausente em crianças e epilepsia persistente.