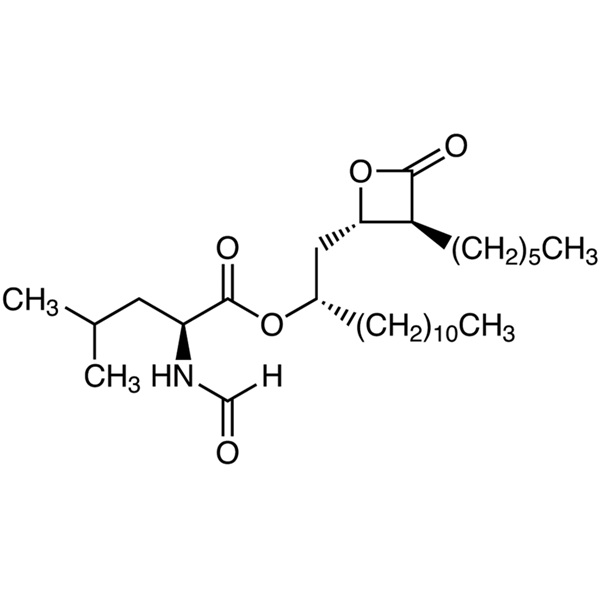
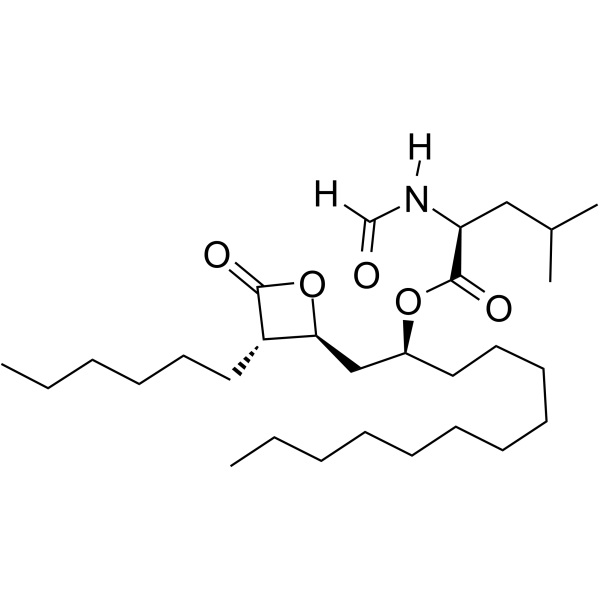
Orlistat CAS 96829-58-2 API para perda de peso, pureza do medicamento 98,0~101,5%
Shanghai Ruifu Chemical Co., Ltd. é o fabricante líder de Orlistat (CAS: 96829 - 58 - 2) com produção comercial de alta qualidade e medicamento para perda de peso. A Ruifu Chemical pode fornecer entrega em todo o mundo, preço competitivo, serviço excelente, quantidades pequenas e a granel disponíveis. Compre Orlistat, Entre em contato: alvin@ruifuchem.com
| Nome Químico | Orlistate |
| Sinônimos | N-Formil-L-Leucina (1S)-1-[[(2S,3S)-3-Hexil-4-Oxo-2-Oxetanil]Metil] Dodecil Éster; (S)-2-Formilamino-4-Metil-Ácido Pentanóico (S)-1-[[(2S,3S)-3-Hexil-4-Oxo-2-Oxetanil]Metil]-Dodecil Éster; Tetrahidrolipstatina; Ro-18-0647 |
| Número CAS | 96829-58-2 |
| Status do estoque | Em estoque, produção em até toneladas |
| Fórmula Molecular | C29H53NO5 |
| Peso molecular | 495,75 |
| Ponto de fusão | 43,0°C~48,0°C |
| Densidade | 0,976±0,06g/cm3 |
| Sensível | Sensível ao calor |
| Solubilidade | Solúvel em Clorofórmio |
| Condição de envio | Sob temperatura ambiente |
| COA e MSDS | Disponível |
| Marca | Ruifu Química |
| Artigo | Especificações |
| Aparência | Pó Cristalino Branco ou Quase Branco |
| Identificação A | Absorção infravermelha |
| Identificação B | O tempo de retenção do pico maior da solução Amostra corresponde ao da solução Padrão, conforme obtido no Ensaio. |
| Pureza/Método de Análise | 98,0~101,5% de C29H53NO5, calculado com base anidra, sem solventes |
| Rotação Específica | -48,0° ~ -51,0° |
| Determinação de Água | ≤0,20% |
| Resíduo na ignição | ≤0,10% |
| Metais Pesados | ≤20 ppm |
| Composto A relacionado ao orlistat | ≤0,20% |
| Composto B relacionado ao orlistat | ≤0,05% |
| Formilleucina | ≤0,20% |
| Composto C relacionado ao orlistat | ≤0,05% |
| Epimero de anel aberto de Orlistat | ≤0,20% |
| D - Leucina Orlistat | ≤0,20% |
| Impureza Individual Não Identificada | ≤0,10% |
| Composto D relacionado ao orlistat | ≤0,20% |
| Orlistat Anel Aberto Amida | ≤0,10% |
| Composto E relacionado ao orlistat | ≤0,20% |
| Impurezas Totais | ≤1,00% |
| Padrão de teste | Farmacopeia Chinesa; USP35 |
| Uso | Ingrediente Farmacêutico Ativo (API) |
Pacote: Garrafa, saco de folha de alumínio, tambor de 25kg/papelão, ou conforme necessidade do cliente.
Condição de armazenamento: Mantenha o recipiente bem fechado e armazene em local fresco, seco (2 ~ 8 ℃) e bem ventilado, longe de substâncias incompatíveis. Fique longe de luz forte, calor e umidade.
Envio: Entregue para todo o mundo por via aérea, pela FedEx / DHL Express. Fornece entrega rápida e confiável.

Orlistat é uma nova forma de medicamento para perda de peso reconhecida internacionalmente. Seu nome comercial é Sainike e foi vendido pela primeira vez na Nova Zelândia em 1998. Orlistat é um inibidor específico da lipase gastrointestinal específico de longo prazo e altamente eficaz, e é insolúvel em água, solúvel em clorofórmio e facilmente solúvel em etanol. Orlistat pode ser usado clinicamente para tratar a obesidade. Normalmente, uma dose de 120 mg é tomada três vezes ao dia, uma hora após a refeição. A perda de peso começa a ocorrer após duas semanas de uso. Pode ser usado continuamente por 6-12 meses, e seus efeitos deixarão de aumentar após a dosagem diária exceder 400mg. Este medicamento é adequado para ser usado em combinação com uma dieta hipocalórica por indivíduos obesos e com sobrepeso, e também pode ser usado como tratamento de longo prazo para pacientes que enfrentaram fatores de risco relacionados ao peso. Orlistat tem um efeito de controle de peso a longo prazo que reduz e mantém o peso e previne a recuperação. O uso do Orlistat pode diminuir a ocorrência de fatores de risco e doenças relacionadas ao peso, incluindo hipercolesterolemia, diabetes tipo 2, tolerância diminuída à glicose, hiperinsulinemia e hipertensão, e pode reduzir o conteúdo de gordura nos órgãos. Orlistat também ajusta os níveis de lipídios no sangue: pode diminuir os triglicerídeos séricos (TG) e o colesterol de lipoproteína de baixa densidade (LDL - C) e pode aumentar a proporção de lipoproteínas de alta densidade para lipoproteínas de baixa densidade em pacientes obesos.
Orlistate
C29H53NO5 495,73
l-Leucina, N-formil-, 1-[(3-hexil-4-oxo-2-oxetanil)metil]dodecil éster, [2S-[2(R*), 3]]-;
N-Formil-l-leucina, éster com (3S,4S)-3-hexil-4-[(2S)-2-hidroxitridecil]-2-oxetanona [96829-58-2].
DEFINIÇÃO
Orlistat contém NLT 98,0% e NMT 101,5% de C29H53NO5, calculado na base anidra, livre de solvente.
IDENTIFICAÇÃO
• A. Absorção infravermelha<197M>
• B. O tempo de retenção do pico maior da solução Amostra corresponde ao da solução Padrão, conforme obtido no Ensaio.
ENSAIO
• Procedimento
[Nota-Evitar o uso de frascos plásticos para preparação ou contenção de qualquer solução nesta análise. ]
Fase móvel: Acetonitrila, ácido fosfórico e água (860: 0,05: 140)
Solução padrão: 0,5 mg/mL de USP Orlistat RS em fase móvel. Injete imediatamente após a preparação ou armazene em 5.
Solução amostra: 0,5 mg/mL de Orlistat em Fase Móvel. Injete imediatamente após a preparação ou armazene em 5.
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: UV 195
Coluna: 3,9-mm × 15-cm; Embalagem L1 de 4-µm
Taxa de fluxo: 1,0 mL/min
Tamanho da injeção: 20 μL
Adequação do sistema
Amostra: Solução padrão
Requisitos de adequação
Desvio padrão relativo: NMT 2,0%
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de orlistat (C29H53NO5) na porção de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = resposta de pico da solução de amostra
rS = resposta de pico da solução padrão
CS = concentração de Orlistat RS USP na solução padrão (mg/mL)
CU = concentração de Orlistat na solução amostra (mg/mL)
Critérios de aceitação: 98,0%-101,5% na base anidra, livre de solventes
IMPUREZAS
Impurezas Inorgânicas
• Resíduo na ignição<281>: NMT 0,1%
• Metais Pesados, Método II<231>: 20 ppm
Impurezas Orgânicas
• Procedimento 1: Limite do Composto A relacionado ao Orlistat
Solução padrão: 0,1 mg/mL de Composto A RS relacionado ao Orlistat da USP em acetona
Solução amostra: 50 mg/mL de Orlistat em acetona
Sistema cromatográfico
(Veja Cromatografia<621>, Cromatografia em Camada Fina.)
Modo: TLC
Adsorvente: camada de 0,25 mm de mistura cromatográfica de sílica gel
Volume de aplicação: 10 µL
Sistema solvente revelador: Tolueno e acetato de etila (4:1)
Solução de detecção: Transferir 2,5 g de ácido fosfomolíbdico e 1 g de sulfato de cérrico para um balão volumétrico de 100 mL, dissolver e diluir com metanol até o volume.
Análise
Amostras: solução padrão e solução amostral
Remova a placa e seque-a completamente ao ar. Pulverize a placa seca com solução de detecção e coloque a placa num forno a 120ºC durante 30 min.
Critérios de aceitação: Qualquer mancha secundária da solução amostra correspondente ao composto A relacionado ao orlistat não é mais intensa que a mancha correspondente da solução padrão (0,2%).
• Procedimento 2: Limite do Composto B Relacionado ao Orlistat
Solução padrão: 0,025 mg/mL de Composto B RS relacionado ao Orlistat da USP em cloreto de metileno
Solução amostra: 50 mg/mL de Orlistat em cloreto de metileno
Solução de amostra enriquecida: 50 mg/mL de Orlistat em solução padrão
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: GC
Detector: Ionização de chama
Coluna: sílica fundida de 0,32-mm x 30-m, revestida com fase estacionária G27 de 0,25-µm
Temperatura da coluna: Consulte a tabela do programa de temperatura abaixo.
Temperatura inicial () Rampa de temperatura (/min) Temperatura final () Tempo de manutenção na temperatura final (min)
50 4 170 -
170 30 300 30
Temperatura
Injetor: 270
Detector: 280
Gás transportador: Hélio
Taxa de fluxo: 30 mL/min
Proporção de divisão: 10:1
Tamanho da injeção: 2 μL
Adequação do sistema
Amostra: Solução padrão
Requisitos de adequação
Desvio padrão relativo: NMT 10,0%
Análise
Amostras: solução de amostra e solução de amostra enriquecida
Calcule a porcentagem do composto B relacionado ao orlistat na porção de Orlistat tomada:
Resultado = [rU/(rSP rU)] × (CS/CT) × 100
rU = resposta de pico do composto B relacionado ao orlistat da solução amostra
rSP = resposta de pico do composto B relacionado ao orlistat da solução de amostra enriquecida
CS = concentração de Composto B RS relacionado ao Orlistat USP na solução padrão (mg/mL)
CT = concentração de Orlistat na solução de amostra enriquecida (mg/mL)
Critérios de aceitação: NMT 0,05% do composto B relacionado ao orlistat é encontrado.
• Procedimento 3
[Nota-Evitar o uso de frascos plásticos para preparação ou contenção de qualquer solução nesta análise. ]
Fase móvel, solução padrão e solução amostra: Prepare conforme indicado no ensaio.
Solução de adequação do sistema: 10 µg/mL de USP Orlistat RS, 0,1 µg/mL de USP Orlistat Related Compound CR RS e 0,25 µg/mL de USP Orlistat Related Compound D RS em fase móvel
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Proceda conforme indicado no Ensaio, exceto para cromatografar a solução de adequação do Sistema.
Adequação do sistema
Amostra: Solução de adequação do sistema
Requisitos de adequação
Relação sinal/ruído: NLT 3 para os picos do composto C relacionado ao orlistat e do composto D relacionado ao orlistat
Desvio padrão relativo: NMT 10,0% para o pico do orlistat
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de cada impureza na porção de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = resposta de pico para cada impureza individual da solução amostral
rS = resposta de pico do USP Orlistat RS da solução padrão
CS = concentração de Orlistat RS USP na solução padrão (mg/mL)
CU = concentração de Orlistat na solução amostra (mg/mL)
F = fator de resposta relativo conforme fornecido na Tabela 1 de Impureza
Critérios de aceitação: Ver Tabela de Impurezas 1.
Tabela de Impureza 1
Nome Critérios de aceitação do fator de resposta relativo do tempo de retenção relativo, NMT (%)
Formileucina 0,10 4,0 0,2
Composto relacionado ao orlistat C 0,13 33 0,05
Orlistat anel aberto epimerb 0,44 1,0 0,2
Composto relacionado ao orlistat D* 0,90 - Calculado em
Procedimento 4
Orlistat anel aberto amidac* 0,90 - Calculado em
Procedimento 4
Orlistate 1,00 - -
d-Leucina orlistatd 1,18 1,0 0,2
Impureza individual não identificada - 1,0 0,1
* Coelutos neste sistema LC, determinados usando o Procedimento 4.
a N-Formil-l-leucina.
b (2S,3R,5S)-5-[(S)-2-Formilamino-4-metil-pentanoiloxi]-2-hexil-3-hidroxi-hexadecanóico ácido.
c N-Formil-l-leucina (S)-1-[(2S,3S)-2-hidroxi-3-[1-fenil-R-etilcarbomoil]nonil]-éster dodecil.
d N-Formil-d-leucina (S)-1-[[(2S,3S)-3-hexil-4-oxo-2-oxetanil]metil]dodecil éster ou enantiômero.
• Procedimento 4: Limite do Composto D relacionado ao Orlistat
Fase móvel: Metanol e água (83:17)
Solução de adequação do sistema: 4 mg/mL de USP Orlistat RS e 2,4 µg/mL de USP Orlistat Related Compound D RS em acetonitrila, respectivamente
Solução padrão: 5,0 mg/mL de USP Orlistat RS em acetonitrila
Solução amostra: 5,0 mg/mL de Orlistat em acetonitrila
Sistema cromatográfico
(Ver Cromatografia 621, Adequação do Sistema.)
Modo: LC
Detector: 205nm
Coluna: 4,0-mm × 25-cm; Embalagem de 5-µm L7
Taxa de fluxo: 0,6 mL/min
Tamanho da injeção: 20 μL
Adequação do sistema
Amostra: Solução de adequação do sistema
Requisitos de adequação
Relação sinal/ruído: NLT 3 para o pico do composto D relacionado ao orlistat
Desvio padrão relativo: NMT 10,0% para o pico do orlistat
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem de cada impureza na porção de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = resposta de pico para cada impureza individual da solução amostral
rS = resposta de pico para USP Orlistat RS da solução padrão
CS = concentração de USP Orlistat RS na solução padrão (µg/mL)
CU = concentração de Orlistat na solução amostra (µg/mL)
F = fator de resposta relativo obtido na Tabela de Impureza 2
Critérios de aceitação: Ver Tabela de Impurezas 2.
Tabela de Impureza 2
Nome Critérios de aceitação do fator de resposta relativo do tempo de retenção relativo, NMT (%)
Composto relacionado ao orlistat D 0,94 1,0 0,2
Orlistate 1,00 - -
Orlistat anel aberto amidaa 1,25 4,3 0,1
a N-Formil-l-leucina (S)-1-[(2S,3S)-2-hidroxi-3-[1-fenil-R-etilcarbomoil]nonil]-dodecil éster.
• Procedimento 5: Limite do Composto E Relacionado ao Orlistat
Tampão: solução de borato 0,4 N, ajustada a um pH de 10,2
Agente derivatizante: solução de o-ftaldeído (OPA). [Nota-Se não for possível obter comercialmente, o agente de derivatização pode ser preparado como 1% de ácido 3-mercaptopropiônico e o-ftaldialdeído em solução tampão de borato 0,4 M.]
Solução A: Transferir 4,1 g de acetato de sódio trihidratado e 40 mg de ácido etilenodiaminotetracético (EDTA) para um balão volumétrico de 1-L. Dissolver em 950 mL de água e ajustar com hidróxido de sódio 0,1 N até pH 7,2. Diluir com água até o volume, adicionar 2,5 mL de tetrahidrofurano e misturar. Filtrar e desgaseificar.
Solução B: Transferir 2,7 g de acetato de sódio trihidratado e 40 mg de EDTA para um balão volumétrico de 1-L. Dissolver em 200 mL de água e ajustar com hidróxido de sódio 0,1 N até pH 7,2. Adicione 800 mL de acetonitrila, filtre e desgaseifique.
Fase móvel: Veja a tabela de gradiente abaixo.
Tempo (min) Solução A (%) Solução B (%)
0 96,7 3,3
20 60 40
24 0 100
38 0 100
38 96,7 3,3
45 96,7 3,3
Solução padrão: Transfira uma quantidade pesada de cerca de 0,2 mg de composto E RS relacionado ao Orlistat da USP para um frasco head-space de 20 mL. Adicione 10 mL de hidróxido de sódio 4 N e feche o frasco. Aqueça o frasco a 100ºC durante 1 h e depois deixe arrefecer até à temperatura ambiente. Transferir 2 mL da solução resultante para um balão volumétrico de 50 mL e diluir com água até completar o volume. A 0,5 mL desta solução adicionar 2,0 mL de Tampão e 0,5 mL de Agente Derivatizante.
Solução de amostra: Prossiga conforme indicado para a solução padrão, mas em vez disso use 25 mg de Orlistat para substituir 0,2 mg de USP Orlistat Related Compound E RS.
Sistema cromatográfico
(Ver Cromatografia<621>, Adequação do Sistema.)
Modo: LC
Detector: Fluorescência 340 nm (excitação); 450 nm (emissão)
Colunas
Guarda: 2,1-mm × 2-cm; Embalagem L1 de 50-µm
Analítico: 2,1-mm × 20-cm; embalagem L1
Taxa de fluxo: 0,5 mL/min
Tamanho da injeção: 20 μL
Adequação do sistema
Amostra: Solução padrão
Requisitos de adequação
Desvio padrão relativo: NMT 6,0% para o pico do composto E relacionado ao orlistat
Análise
Amostras: solução padrão e solução amostral
Calcule a porcentagem dessa impureza na porção de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = resposta de pico para o composto E relacionado ao orlistat na solução amostra
rS = resposta de pico para o Composto E RS relacionado ao Orlistat da USP na solução padrão
CS = concentração de Composto E RS relacionado ao Orlistat USP na solução padrão (mg/mL)
CU = concentração de Orlistat na solução amostra (mg/mL)
Critérios de aceitação
Impureza individual: NMT 0,2% do composto E relacionado ao orlistat é encontrado.
Impurezas totais: NMT é encontrado 1,0% do total de impurezas, somando-se os resultados dos Procedimentos 1, 2, 3, 4 e 5.
TESTES ESPECÍFICOS
• Rotação óptica, rotação específica<781>
Solução amostra: 30 mg/mL em álcool desidratado
Critérios de aceitação: Entre -48,0 e -51,0, aos 20
• Determinação de Água, Método Ic<921>: NMT 0,2%
REQUISITOS ADICIONAIS
• Embalagem e Armazenamento: Conservar em recipientes bem fechados entre 2 e 8℃.
• Padrões de referência da USP<11>
USP Orlistat RS
Composto A RS relacionado ao Orlistat da USP
Composto B RS relacionado ao Orlistat da USP
Composto C RS relacionado ao Orlistat da USP
Composto D RS relacionado ao Orlistat da USP
Composto E RS relacionado ao Orlistat da USP
USP35