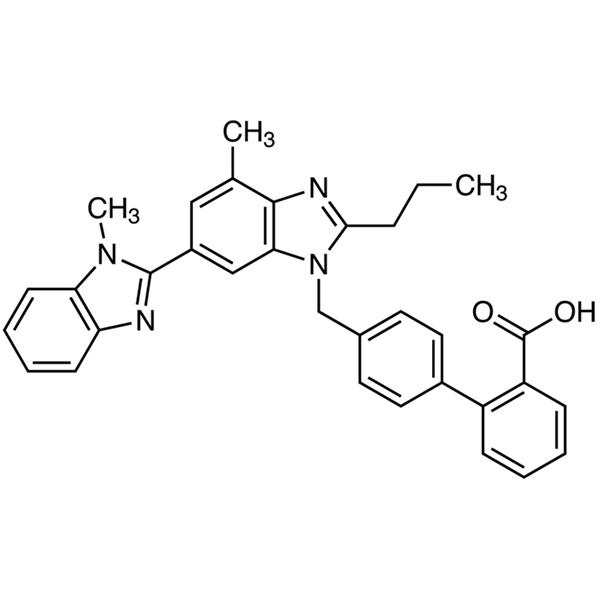
Telmisartan CAS 144701-48-4 Ensaio 99,0%~101,0% API EP Padrão de alta qualidade
Shanghai Ruifu Chemical Co., Ltd. é o fornecedor líder de Telmisartan (CAS: 144701 - 48 - 4) com alta qualidade, pode atender ao padrão da USP / EP. DMF/CEP/GMP disponíveis.
A Ruifu Chemical fornece APIs e intermediários farmacêuticos há mais de 15 anos.
A Ruifu Chemical pode fornecer entrega em todo o mundo, preço competitivo e serviço excelente.
Para comprar Telmisartan e intermediários relacionados, entre em contato conosco por e-mail:alvin@ruifuchem.com
| Nome Químico | Telmisartana |
| Sinônimos | 4'-[[4-Metil-6-(1-Metil-1H-Benzimidazol-2-il)-2-Propil-1H-Benzimidazol-1-il]metil]bifenil-2-Ácido carboxílico; 4'-[(1,4'-Dimetil-2'-propil[2,6'-bi-1H-Benzimidazol]-1'-il)metil]-[1,1'-Bifenil]-2-Ácido carboxílico |
| Número CAS | 144701-48-4 |
| Status do estoque | Em estoque, produção em até toneladas |
| Fórmula Molecular | C33H30N4O2 |
| Peso molecular | 514,63 |
| Ponto de fusão | 261,0 ~ 263,0 ℃ |
| Solubilidade em Água | Insolúvel |
| Estabilidade | Higroscópico |
| Condição de armazenamento | 2-8℃ |
| COA e MSDS | Disponível |
| Origem do Produto | Xangai, China |
| Categorias de produtos | API (Ingrediente Farmacêutico Ativo) |
| Marca | Ruifu Química |
| Itens | Especificações | Resultados |
| Aparência | Pó cristalino branco ou ligeiramente amarelado | Pó Cristalino Branco |
| Solubilidade | Deve atender ao requisito | Em conformidade |
| Identificação IR | Deve corresponder à absorção infravermelha do RS | Em conformidade |
| Aparência da solução | Deve atender ao requisito | Em conformidade |
| Substâncias Relacionadas | ||
| Impureza A | ≤0,15% | 0,05% |
| Impureza B | ≤0,15% | 0,02% |
| Impureza C | ≤0,20% | 0,03% |
| Impureza D | ≤0,20% | 0,05% |
| Impurezas não especificadas: | ≤0,10% | 0,06% |
| Impurezas Totais | ≤1,00% | 0,30% |
| Solventes Residuais | ||
| Metanol | ≤0,30% | Não detectado |
| Etanol | ≤0,50% | 0,031% |
| Dicloreto de metileno | ≤0,06% | Não detectado |
| n-Hexano | ≤0,029% | Não detectado |
| Éster etílico de ácido acético | ≤0,50% | Não detectado |
| Tolueno | ≤0,089% | 0,025% |
| Ácido Acético | ≤0,50% | 0,036% |
| Perda na secagem | ≤0,50% | 0,20% |
| Cinza Sulfatada | ≤0,10% | Em conformidade |
| Ponto de fusão | 261,0 ~ 263,0 ℃ | 261,5 ~ 262,1 ℃ |
| Tamanho de partícula | 90% Menos de 200μm | Em conformidade |
| Ensaio | 99,0%~101,0% (Substância Seca) | 99,9% |
| Padrão de teste | Em conformidade com a Farmacopeia Europeia 7.0 | Em conformidade |
Pacote: Garrafa, saco de papel alumínio, tambor de 25kg/papelão, ou conforme necessidade do cliente.
Condição de armazenamento: Mantenha o recipiente bem fechado. Armazenar em local fresco, seco (2-8℃) e bem ventilado, longe de substâncias incompatíveis. Mantenha longe da luz solar; evite fontes de fogo e calor; evite a umidade.
Envio: Entregue para todo o mundo por via aérea, marítima, por FedEx / DHL Express. Fornece entrega rápida e confiável.

Símbolos de perigo Xi - Irritante
Códigos de risco 36/37/38 - Irritante para os olhos, vias respiratórias e pele.
Descrição de segurança S22 - Não respire poeira.
S24/25 - Evite o contato com a pele e os olhos.
S36 - Use roupas de proteção adequadas.
S26 - Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico.
WGK Alemanha 2
RTECS DV2037500
Código HS 2933990099
Telmisartan (CAS: 144701-48-4) é um derivado do benzimidazol e um antagonista não peptídico do receptor da angiotensina II com propriedade anti-hipertensiva. Telmisartan antagoniza seletivamente a ligação da angiotensina II ao receptor do subtipo AT1, localizado no músculo liso vascular e na glândula adrenal. O antagonismo resulta em vasodilatação e inibe a produção de aldosterona mediada pela angiotensina II, que por sua vez leva a uma diminuição de sódio e água, bem como a um aumento na excreção de potássio, levando a uma redução subsequente na pressão arterial. Telmisartan é um novo tipo de medicamento para pressão arterial, usado isoladamente ou em combinação com outras classes de anti-hipertensivos para o tratamento da hipertensão. O Telmisartan foi originalmente formulado pela empresa farmacêutica alemã Boehringer Ingelheim; ganhou a patente alemã EP502.314 em 1991, foi aprovado pela primeira vez para entrar no mercado americano em novembro de 1998 e depois entrou nos mercados alemão, filipino, australiano, belga, britânico e outros.
C33H30N4O2
Senhor 514,6
[144701-48-4]
DEFINIÇÃO
4′-[[4-Metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-ácido carboxílico.
Conteúdo: 99,0 por cento a 101,0 por cento (substância seca).
PERSONAGENS
Aparência: pó cristalino branco ou levemente amarelado.
Solubilidade: praticamente insolúvel em água, pouco solúvel em metanol, pouco solúvel em cloreto de metileno. Dissolve-se em uma solução de hidróxido de sódio a 40 g/L R.
Apresenta polimorfismo (5.9).
IDENTIFICAÇÃO
Espectrofotometria de absorção no infravermelho (2.2.24).
Comparação: Telmisartana CRS.
Caso os espectros obtidos no estado sólido apresentem diferenças, dissolver a substância a ser examinada e a substância de referência separadamente em etanol anidro quente R, evaporar até a secura e registrar novos espectros utilizando os resíduos.
TESTES
Aparência da solução. A solução não é mais intensamente colorida do que a solução de referência Y4 (2.2.2, Método II).
Dissolva 0,5 g em uma solução de hidróxido de sódio R a 40 g/L e dilua para 10 mL com o mesmo solvente.
Substâncias relacionadas. Cromatografia líquida (2.2.29).
Solução de teste. A 25 mg da substância a ser examinada adicione cerca de 5 mL de metanol R e 100 μL de uma solução de hidróxido de sódio a 40 g/L R. Dissolver usando sonicação e diluir para 50,0 mL com metanol R.
Solução de referência (a). Dilua 1,0 mL da solução de teste para 10,0 mL com metanol R. Dilua 1,0 mL desta solução para 100,0 mL com metanol R.
Solução de referência (b). Dissolva o conteúdo de um frasco de telmisartana para adequação do sistema CRS (contendo impurezas A, B, C, E e F) em 2 mL de metanol R.
Solução de referência (c). A 5 mg de telmisartana para identificação de pico de CRS (contendo impureza D) adicione cerca de 5 mL de metanol R e 100 μL de uma solução de hidróxido de sódio a 40 g/L R. Dissolva usando sonicação e dilua para 10 mL com metanol R.
Coluna:
– tamanho: l = 0,125 m, Ø = 4,0 mm;
– fase estacionária: gel de sílica octadecilsilil tampado na extremidade para cromatografia R (5 μm) com tamanho de poro de 10 nm;
– temperatura: 40 °C.
Fase móvel:
– fase móvel A: dissolver 2,0 g de dihidrogenofosfato de potássio R e 3,8 g de pentanossulfonato de sódio monohidratado R1 em 900 mL de água para cromatografia R, ajustar para pH 3,0 com ácido fosfórico diluído R e diluir para
1000 mL com água para cromatografia R;
– fase móvel B: metanol R1, acetonitrila para cromatografia R (20:80 V/V);
Tempo (min) Fase móvel A (porcentagem V/V) Fase móvel B (porcentagem V/V)
0 - 3 70 30
3 - 28 70 → 20 30 → 80
Taxa de fluxo: 1 mL/min.
Detecção: espectrofotômetro a 230 nm.
Injeção: 10 μL.
Identificação de impurezas: utilize o cromatograma fornecido com o telmisartan para adequação do sistema CRS e o cromatograma obtido com solução de referência (b) para identificar os picos devidos às impurezas A, B, C, E e F;
use o cromatograma fornecido com telmisartana para identificação do pico CRS e o cromatograma obtido com solução de referência (c) para identificar o pico devido à impureza D.
Retenção relativa com referência ao telmisartan
(tempo de retenção = cerca de 15 min): impureza A = cerca de 0,2;
impureza E = cerca de 0,6; impureza F = cerca de 0,7;
impureza B = cerca de 0,9; impureza C = cerca de 1,5;
impureza D = cerca de 1,6.
Adequação do sistema: solução de referência (b):
– o cromatograma obtido com a solução de referência (b) é semelhante ao cromatograma fornecido com telmisartana para adequação do sistema CRS;
– resolução: mínimo 3,0 entre os picos devido à impureza B e telmisartana.
Limites:
– impurezas C, D: para cada impureza, não mais que o dobro da área do pico principal no cromatograma obtido com a solução de referência (a) (0,2 por cento);
– impurezas A, B: para cada impureza, não mais que 1,5 vezes a área do pico principal no cromatograma obtido com a solução de referência (a) (0,15 por cento);
– impurezas não especificadas: para cada impureza, não mais que a área do pico principal no cromatograma obtido com a solução de referência (a) (0,10 por cento);
– total: não mais que 10 vezes a área do pico principal no cromatograma obtido com solução de referência (a) (1,0 por cento);
– desconsiderar limite: 0,5 vezes a área do pico principal no cromatograma obtido com solução de referência (a) (0,05 por cento).
Perda por secagem (2.2.32): máximo de 0,5%, determinado em 1.000g por secagem em estufa a 105°C.
Cinza sulfatada (2.4.14): máximo 0,1%, determinado em 1,0g.
ENSAIO
Dissolver 0,190 g em 5 mL de ácido fórmico anidro R. Adicionar 75 mL de anidrido acético R. Titular com ácido perclórico 0,1 M, determinando o ponto final potenciometricamente (2.2.20).
1 mL de ácido perclórico 0,1 M é equivalente a 25,73 mg de C33H30N4O2.
IMPUREZAS
Impurezas especificadas: A, B, C, D.
Outras impurezas detectáveis (as seguintes substâncias seriam, se presentes em um nível suficiente, detectadas por um ou outro dos testes da monografia. Elas são limitadas pelo critério de aceitação geral para outras impurezas/impurezas não especificadas e/ou pela monografia geral Substâncias para uso farmacêutico (2034). Portanto, não é necessário identificar essas impurezas para demonstração de conformidade. Ver também 5.10. Controle de impurezas em substâncias para uso farmacêutico): E, F, G, H, I, J.
A. 4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol,
B. 4′-[[7-metil-5-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-ácido carboxílico,
C. tert-butil 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carboxilato,
D. estrutura desconhecida,
E. 1-[(2′-carboxi[1,1′-bifenil]-4-il)metil]-4-metil-2-propil-1H-benzimidazol-6-ácido carboxílico,
F. 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carboxamida,
G. 4′-[[4-metil-6-(1-metil-1H-benzimidazol-2-il)-2-propil-1H-benzimidazol-1-il]metil][1,1′-bifenil]-2-carbonitrila,
H. tert-butil 4′-(bromometil)[1,1′-bifenil]-2-carboxilato,
I. metil 4′-[(1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibenzimidazol]-3′-il)metil][1,1′-bifenil]-2-carboxilato,
J. 4′-[(5-cloro-1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibenzimidazol]-3′-il)metil][1,1′-bifenil]-2-ácido carboxílico.